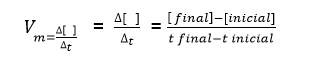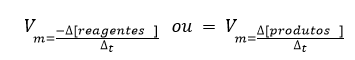Facilite os conceitos de Cinética química e suas reações

Você sabe quais os conceitos de Cinética Química e quais os fatores que interferem na velocidade de uma reação química?
Para maiores esclarecimentos do conteúdo, veja a seguir o que você precisa ficar atento para se sair bem nas questões.
 O conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-a-dia, por exemplo, quando guardamos alimentos na geladeira para retardar sua decomposição ou usamos panela de pressão para aumentar a velocidade de cozimento dos alimentos.
O conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-a-dia, por exemplo, quando guardamos alimentos na geladeira para retardar sua decomposição ou usamos panela de pressão para aumentar a velocidade de cozimento dos alimentos.
Conceito de Cinética Química
O estudo da velocidade das reações químicas e dos fatores que podem acelerá-la ou retardá-la constitui a chamada cinética química. O estudo da cinética é sem dúvida de grande importância na nossa vida cotidiana, já que muitas reações químicas de interesse industrial podem ser aceleradas, gastando menos tempo para ocorrerem e, portanto, tornando o processo mais econômico.[1]
Velocidade das reações x Cinética Química
A velocidade média de uma reação, isto é, a velocidade de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do tempo.
A expressão da velocidade média será dada por:
Para calcular o Δ [reagentes], é necessário observar que ele apresenta um valor menor do que zero, ou seja, um valor negativo, pois a concentração final é menor do que a inicial. Para não trabalhar com valores negativos, usamos –Δ [reagentes] na expressão da velocidade média dos reagentes. Assim, a velocidade média é expressa por:
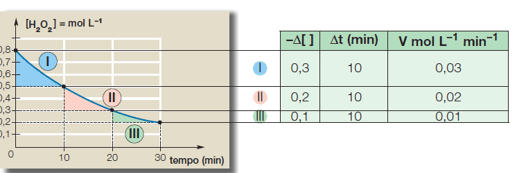
Exemplo de aplicação dessa expressão: O gráfico a seguir mostra a variação da concentração em mol/L da água oxigenada em função do tempo. A decomposição da água oxigenada é dada pela equação:
Quando analisarmos os valores das velocidades médias de consumo do H2O2, notamos que eles não são constantes e que o valor máximo é encontrado no início da reação. Diante disso, concluímos que a velocidade média diminui de acordo com a diminuição da concentração.
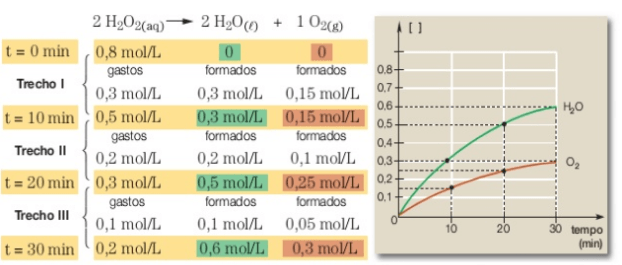
Com base nos dados do gráfico e conhecendo a estequiometria da reação, em que a decomposição de 2 mol de H2O2 produz 2 mol de H2O e 1 mol de O2, podemos construir um novo gráfico, que indique a concentração em mol/L dos produtos.
Analisando a velocidade média das três substâncias envolvidas na reação num mesmo intervalo de tempo, por exemplo, de 0 a 10 min (Δt = 10 min), temos:
Assim, concluímos que os valores das velocidades médias obedecem à proporção estequiométrica da reação: 2: 2: 1.
Se dividirmos os valores das velocidades médias pelos respectivos coeficientes estequiométricos, encontraremos um mesmo valor, que será considerado o valor da velocidade média da reação.
Assim, para a reação dada:
Temos:
Condições para ocorrência de reações
Para que uma reação química ocorra, devem ser satisfeitas determinadas condições. São elas:
Afinidade Química – É a tendência intrínseca de cada substância de entrar em reação com uma outra substância. Por exemplo: ácidos têm afinidades por bases, não-metais têm afinidades por metais, reagentes nucleófilos têm afinidade por reagentes eletrófilos.
Contato entre as Moléculas dos Reagentes: As reações químicas ocorrem como resultado de choques entre as moléculas dos reagentes que se encontram em movimento desordenado e contínuo.
Exemplo: A2 + B2 → 2AB
Teoria das colisões
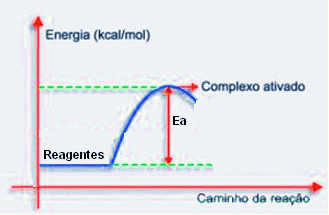
A Teoria das Colisões diz que para que uma reação ocorra, a colisão entre as partículas das substâncias reagentes deve acontecer através de uma orientação adequada e com uma energia maior que a energia mínima necessária para a ocorrência da reação.
Essa energia mínima que deve ser fornecida aos reagentes é denominada Energia de Ativação (Ea). Sem atingi-la, a reação não ocorre.
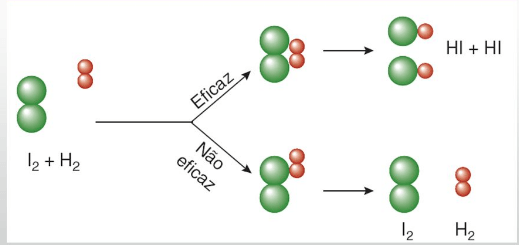
Quando colocamos duas substâncias em contato, suas partículas começam a colidir umas com as outras. Nem todas as colisões são eficazes, isto é, nem todas dão origem a novos produtos. No entanto, as colisões que rompem as ligações formadas e formam novas ligações, são denominadas colisões eficazes ou efetivas.
Essas colisões ocorrem de forma adequada: seu choque é frontal geometricamente e bem orientado. Observe abaixo como isso ocorre:
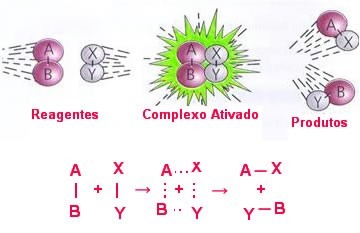
No choque eficaz as moléculas absorvem a quantidade de energia mínima necessária (energia de ativação) para a formação do complexo ativado, ou seja, um estado intermediário (estado de transição) entre os reagentes e os produtos. Nessa estrutura, as ligações dos reagentes estão enfraquecidas e as dos produtos estão sendo formadas.
Observe uma reação genérica que mostra essa formação do complexo ativado abaixo:
Note que quando ocorre o choque eficaz, forma-se momentaneamente o complexo ativado, no qual as ligações entre os átomos AB e XY estão se rompendo e as ligações que uniram os átomos nas moléculas AX e YB estão se formando.
Observe no diagrama que se não for atingida a energia de ativação, não é possível formar o complexo ativado, pois ela serve como uma barreira energética a ser ultrapassada para que a reação química ocorra.
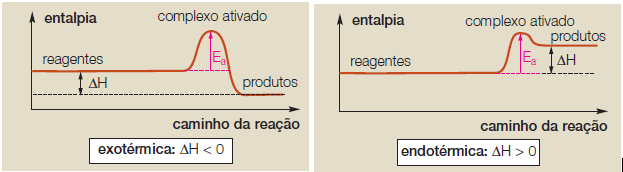
Para reações exotérmicas (reações que liberam energia – ΔH < 0) e endotérmicas (reações que absorvem energia – ΔH > 0), temos os diagramas:
Fatores que influenciam a velocidade de uma reação
Superfície de contato
Quando um reagente está no estado sólido, a reação ocorrerá na sua superfície. Assim, quanto mais fragmentado (disperso) for esse reagente, maior será o número de choques, e maior será a velocidade da reação.
Concentração dos Reagentes
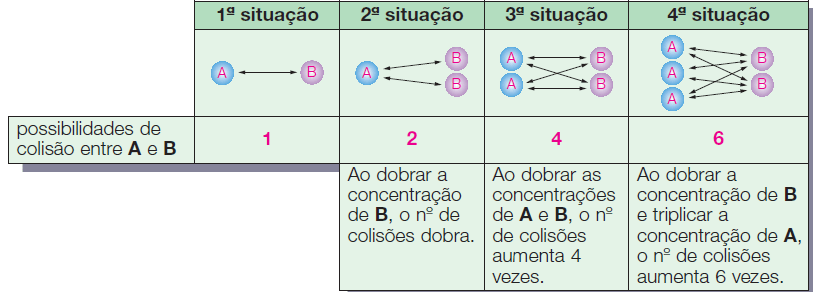
A velocidade de uma reação depende também da concentração dos reagentes, pois ela está relacionada com o número de choques entre as moléculas. Vamos aplicar esse conceito a uma reação genérica:
O número de choques e, consequentemente, a velocidade irão depender das concentrações de A e B. Vamos considerar quatro situações em que varia o número de moléculas de A e B, num mesmo volume e numa mesma temperatura:
Essa relação demonstra que o número de colisões e, consequentemente, a velocidade da reação são proporcionais ao produto das concentrações.
Temperatura x Cinética Química
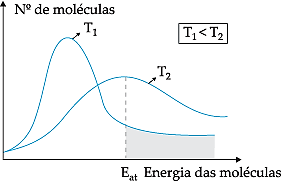
Todo aumento de temperatura provoca o aumento da energia cinética média das moléculas, fazendo com que aumente o número de moléculas em condições de atingir o estado correspondente ao complexo ativado, aumentando o número de colisões eficazes ou efetivas e, portanto, provocando aumento na velocidade da reação. Podemos representar graficamente a relação entre o número de moléculas de um sistema em função da cinética destas moléculas (curva de Maxwell-Boltzmann).
Note que, em uma temperatura T1, a quantidade de moléculas em condições de reagir (com energia igual ou superior a Eat) é menor que em uma temperatura maior T2. O aumento na temperatura faz com que ocorra um aumento da energia cinética média das moléculas, deslocando a curva para a direita, fazendo com que o número de moléculas em condições de reagir aumente. Uma regra experimental, que relaciona o aumento de temperatura com a velocidade de uma reação é a regra de Van’t Hoff: “Um aumento de 10 °C na temperatura duplica a velocidade de uma reação química”.
Pressão
A pressão só apresenta influência apreciável na velocidade de reações em que pelo menos um dos reagentes é gasoso. O aumento da pressão causa diminuição de volume acarretando aumento no número de choques, o que favorece a reação e, portanto, aumenta a sua velocidade.
Com a diminuição da pressão, aumenta o volume do recipiente, diminuindo o número de choques moleculares entre os reagentes e, portanto, diminuindo a velocidade da reação.
Superfície do Reagente Sólido
Quanto maior a superfície do reagente sólido, maior o número de colisões entre as partículas dos reagentes e maior a velocidade da reação. Em uma reação que ocorre com presença de pelo menos um reagente sólido, quanto mais finamente dividido for este sólido, maior será a superfície de contato entre os reagentes.
Exemplo:
Na equação acima, que representa a reação, se utilizarmos, em um primeiro experimento, zinco em barra e, em um segundo, zinco em pó, a velocidade da reação no segundo será muito maior que no primeiro experimento.
Catalisador
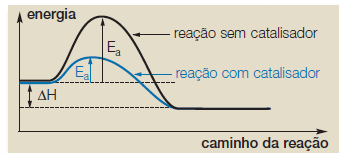
Catalisador é a substância que aumenta a velocidade de uma reação, sem sofrer qualquer transformação em sua estrutura. O aumento da velocidade é conhecido como catálise. O catalisador acelera a velocidade, alterando o mecanismo da reação, o que provoca a formação de um complexo ativado de energia mais baixa. São características dos catalisadores:
A) o catalisador não fornece energia à reação;
B) o catalisador participa da reação formando um complexo ativado de menor energia;
C) o catalisador não altera o ∆h da reação;
D) o catalisador pode participar das etapas da reação, mas não é consumido pela mesma.
As reações envolvendo catalisadores podem ser de 2 tipos:
– catálise homogênea: catalisador e reagentes no mesmo estado físico;
– catálise heterogênea: catalisador e reagentes em estados físicos diferentes.
Exemplos
Catálise homogênea
Catálise heterogênea
Observação:
Existem casos de autocatálise, no qual o catalisador é um dos produtos da própria reação. Estas reações iniciam lentamente e à medida que o catalisador vai se formando, a velocidade da reação vai aumentando. Encontramos substâncias que atuam no catalisador, aumentando sua atividade catalítica: são chamadas de ativadores de catalisador ou promotores. Outras diminuem ou mesmo destroem a ação do catalisador: são chamadas venenos de catalisador.
Inibidor
O inibidor busca atuar de uma forma oposta às de atuação dos catalisadores. Portanto, entenda catalisador e entenderá, por oposição, inibidor.
Concentração dos Reagentes
Lembrando que uma reação se processa por meio de choques moleculares, conclui-se facilmente que uma maior concentração dos reagentes determina um aumento da velocidade da reação pois, aumentando-se a concentração, aumenta-se o número de moléculas reagentes e, consequentemente, aumenta, também, o número de choques moleculares.
E então, o que achou deste post sobre cinética química? Preciso muito da sua opinião para aperfeiçoar minhas publicações aqui no blog.
Deixe um comentário dizendo o que achou, e ajude a manter esse trabalho vivo. É sua manifestação que me empolga a manter o conteúdo aqui. Até a próxima!
[1] Usberco, J.; Salvador, E. 2002. Química. Editora Saraiva.

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.