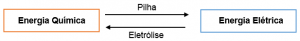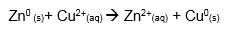Como aquela matéria sobre Eletroquímica fará você garantir mais acertos no seu concurso

Saudações novamente meus queridos concurseiros. Vamos dar aquela relembrada em Eletroquímica? Então da aquela respirada e se prepara pra esse blog que já vem com tudo para te ajudar a estudar essa matéria.
O Que é Eletroquímica?
É a parte da química que estuda a produção de corrente elétrica por meio da transferência de elétrons nas reações de óxido-redução (jajá comento o que é oxirredução). O conteúdo da eletroquímica é basicamente dividido no estudo de Pilhas e Eletólise. Em eletroquímica ocorrem reações de conversão de energia química em energia elétrica e vice-versa.
Número de Oxidação
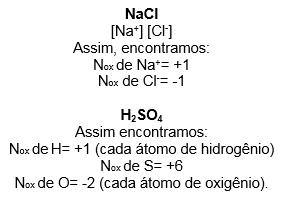
Na eletroquímica, esse “número” é bem famosinho e é conhecido como Nox. Ele é a representação real ou imaginária da carga formal. Para ajudar a entender, pense que é a carga que um átomo teria se estivesse participando de uma ligação iônica. Da uma olhada nesses exemplos ai:
Oxirredução
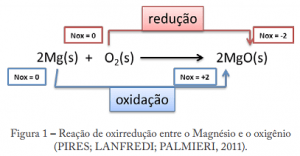
A reação de oxirredução acontece quando a uma transferência simultânea de elétrons. Ou seja, uma espécie ganha elétrons ao mesmo tempo que outra perde elétrons.
Oxidação: ocorre quando o número de oxidação de um átomo aumenta. E para que ocorra um aumento no número de oxidação, o átomo precisa perder elétrons.
Redução: ocorre quando o número de oxidação diminui. Para que ocorra essa diminuição, o átomo precisa receber elétrons.
Por esse esqueminha abaixo fica um pouco mais simples de entender:
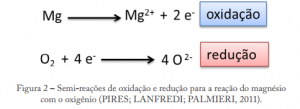
Nesta reação o magnésio é oxidado enquanto o oxigênio é reduzido (igual dito antes: simultaneamente). Assim entendemos que as reações de oxidação e redução se completam, e nesse caso, o magnésio é o agente redutor e o oxigênio o agente oxidante. Para facilitar esta parte do estudo da Eletroquímica, estas etapas podem ainda ser separadas e escritas na forma de duas reações diferentes, contudo é importante lembrar que elas não ocorrem isoladas uma da outra e sim juntas e simultaneamente.
Pilhas
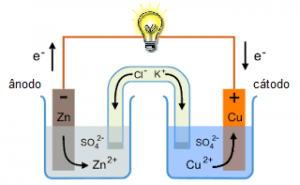
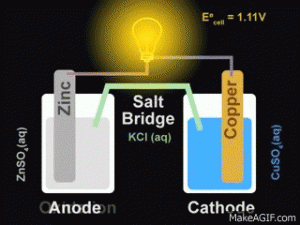
Pilhas ou célula voltaicas são dispositivos que transformam energia química em energia elétrica por meio de um sistema apropriado e montado para aproveitar o fluxo de elétrons provenientes de uma reação química de oxirredução. A pilha de Daniel é um exemplo deste sistema.
É formado por uma placa de zinco mergulhada em uma solução de sulfato de zinco, e uma placa de cobre imersa em uma solução de sulfato de cobre. As duas placas (eletrodos) são conectadas por um fio metálico, que permite a passagem de elétrons de um eletrodo ao outro. As duas soluções são interligadas por uma ponte salina, um tubo de vidro recurvado que contém uma solução de um sal (sulfato de sódio, neste caso) e possui pedaços umedecidos de algodão nas extremidades.
Fonte: https://bit.ly/2PCLBrJ
Assim, podemos prever a ocorrência das seguintes semi-reações:
Para ficar ainda mais fácil de entender da uma olhada nesse gif:
Somando as semi-reações acima, obtemos a reação de oxirredução ocorrida entre a barra de zinco e a solução de Cu2+.
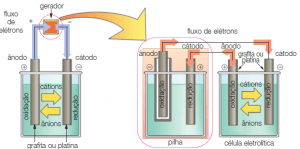
Eletrólise
É um processo não-espontâneo, em que a passagem de uma corrente elétrica através de um sistema líquido, no qual existam íons, produz reações químicas. As eletrólises são realizadas em cubas eletrolíticas, nas quais a corrente elétrica é produzida por um gerador (pilha).
Nesse sistema, os eletrodos são geralmente inertes, formados por platina ou grafita (carvão). As substâncias que serão submetidas à eletrólise podem estar liquefeitas (fundidas) ou em solução aquosa. Mas não vamos nos adentrar nesses assuntos aqui (pelo título do blog dá pra ver que é só uma revisão de conceitos né).
Fonte: https://bit.ly/2CjYLrR
Importante: No processo de eletrólise, os elétrons emergem da pilha (gerador) pelo ânodo (–) e entram na célula eletrolítica pelo cátodo (–) no qual produzem redução. Na célula eletrolítica, os elétrons emergem pelo ânodo (+), no qual ocorre oxidação, e chegam à pilha pelo seu cátodo (+).
E ai aventureiros dos estudos? O que acharam dessa leitura? Como sempre sei que foi bem tranquilo né? (talvez não kkk)
Não se esqueçam de deixar ai seus comentários e sugestões.
Tchau e até a próxima!
Tutor: Fernando Massarotti
Referências:
Química Nova Escola, Nº11 – Pilhas e Baterias. Maio, 2000.

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.