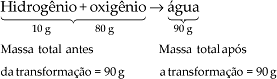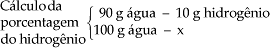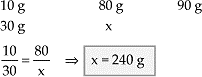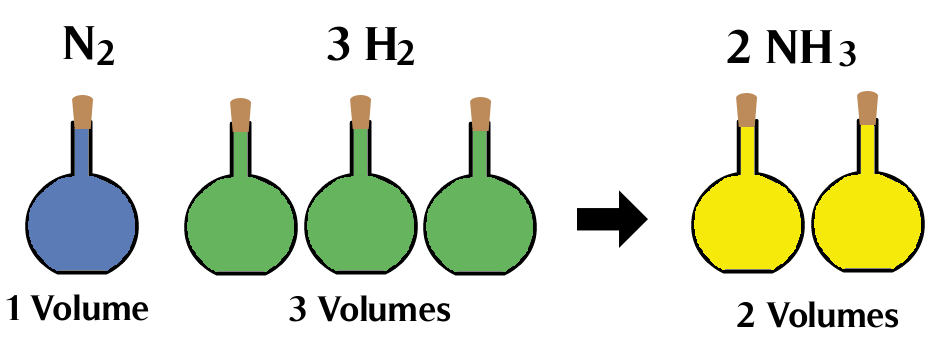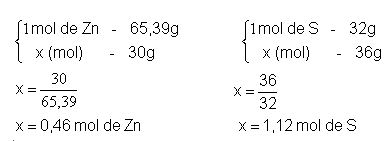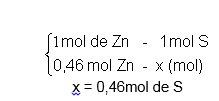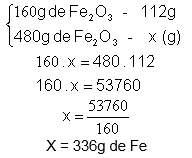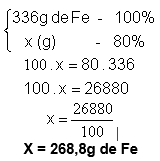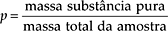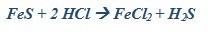Veja o que você deve saber sobre Estequiometria, que tal rever alguns conceitos?

A Estequiometria é o cálculo das quantidades das substâncias envolvidas numa reação química é chamado de cálculo estequiométricos — palavra derivada do grego stoicheia = partes mais simples e metreim = medida. São cálculos que envolvem proporções de átomos em uma sustância ou que relacionam-se com proporções de coeficientes de uma equação química.
Bases para o estudo da estequiometria
Fonte: timetoast.com
As bases para o estudo da estequiometria das reações químicas foram lançadas por cientistas que conseguiram expressar matematicamente as regularidades que ocorrem nas reações químicas, através das Leis das Combinações Químicas.
Essas leis foram divididas em dois grupos:
– Leis ponderais: relacionam as massas dos participantes de uma reação.
– Lei volumétrica: relaciona os volumes dos participantes de uma reação.
Leis ponderais na estequiometria
As Leis Ponderais das Reações Químicas são um conjunto de postulados que regem a lógica das reações químicas, relacionando a massa dos produtos e reagentes e também fazendo menção à quantidade de matéria dos mesmos.
Lei de Lavoisier na estequiometria
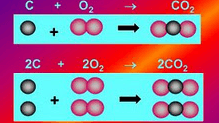
A Lei da Conservação das Massas ou conservação das matérias, postulada por Lavoisier no final do século XVIII, é uma das leis ponderais e diz o seguinte: numa reação química, a soma das massas dos reagentes é igual à soma das massas dos produtos. Ou seja, a massa é sempre conservada em qualquer reação química. A partir disso, lembra-se da célebre frase dita por Lavoisier: “Nada se cria, nada se perde; tudo se transforma”. Deve-se ressaltar, a título de observação, que numa reação atômica (que não é reação química), a massa dos produtos é diferente da massa dos reagentes apenas se não se considerar prótons e nêutrons como produtos ou reagentes.
Exemplos:
Conclusão: De acordo com os postulados de Lavoisier, a massa total das substâncias, antes da transformação química, é igual à massa total após a transformação ou na natureza nada se perde, nada se cria, tudo se transforma.
Lei de Proust na estequiometria
A Lei de Proust é conhecida como Lei das proporções constantes ou lei das proporções definidas. Esta lei foi inserida pelo químico francês Joseph Louis Proust (1754-1826), que realizou experimentos com substâncias puras e concluiu que independentemente do processo usado para obtê-las, a composição em massa dessas substâncias era constante.
A Lei de Proust é definida da seguinte maneira: As massas dos reagentes e produtos participantes de uma reação mantêm uma proporção constante. Através de análises de inúmeras substâncias adquiridas por diferentes processos foi possível verificar que uma mesma substância tem sempre a mesma composição qualitativa e quantitativa.
Exemplo: No caso da água, temos:
90 g de água fornece 10 g de Hidrogênio e 80 g de oxigênio.
x = 11,11% de Hidrogênio
x = 88,88% de oxigênio
Outra consequência da lei de Proust é o cálculo estequiométrico.
Hidrogênio + oxigênio → água
Para 10 g de Hidrogênio é necessário de 80 g de oxigênio para que ocorra a reação, em 30g de Hidrogênio precisamos de 240 g de oxigênio. Assim, a proporção, em massa, com que o Hidrogênio reage com o oxigênio é a mesma nas duas reações.
Lei Volumétrica na estequiometria
O físico e químico Gay Lussac, teve suas contribuições na Química, e uma delas é a lei da combinação de volumes, que é também conhecida como Lei volumétrica, que define o princípio de que nas mesmas condições de temperatura e pressão, os volumes dos gases participantes de uma reação têm entre si uma relação de números inteiros e pequenos.
Conduta de Resolução
Conforme observado nos itens acima, na estequiometria, os cálculos serão estabelecidos em função da lei de Proust e Gay-Lussac, neste caso para reações envolvendo gases e desde que estejam todos nas mesmas condições de pressão e temperatura.
Assim, devemos tomar os coeficientes da reação devidamente balanceados, e, a partir deles, estabelecer a proporção em mols dos elementos ou substâncias da reação.
Exemplo: reação de combustão do álcool etílico:
C2H6O + O2 → CO2 + H2O
Após balancear a equação, ficamos com:
Após o balanceamento da equação, pode-se realizar os cálculos, envolvendo os reagentes e/ou produtos dessa reação, combinando as relações de várias maneiras:
Importante:
– Uma equação química só estará corretamente escrita após o acerto dos coeficientes, sendo que, após o acerto, ela apresenta significado quantitativo.
– Relacionar os coeficientes com mols. Teremos assim uma proporção inicial em mols;
– Estabelecer entre o dado e a pergunta do problema uma regra de três. Esta regra de três deve obedecer aos coeficientes da equação química e poderá ser estabelecida, a partir da proporção em mols, em função da massa, em volume, número de moléculas, entre outros, conforme dados do problema.
Tipos de Cálculos Estequiométricos
**Caso o sistema não se encontre nas CNTP, deve-se calcular a quantidade em mols do gás e, a seguir, através da equação de estado, determinar o volume correspondente.
A resolução de problemas que envolvem a estequiometria será facilitada se obedecer, inicialmente à seguinte sequência:
1º) Escreva a equação envolvida;
2º) Acerte os coeficientes da equação (ou equações);
Lembre-se: equação balanceada: coeficiente = número de mols
3º) Destaque, na equação química, a(s) substância(s) envolvida(s) nos dados e a(s) pergunta(s) do problema;
4º) Abaixo das fórmulas, escreva a relação molar e transforme-a segundo os dados do exercício (mol, gramas, número de átomos ou moléculas, volume molar);
RELAÇÃO EM MASSA
Os dados do problema e as quantidades de incógnitas pedidas são expressos em termos de massa. Exemplo:
Na reação N2(g) + 3H2(g) → 2NH3(g) qual a massa de NH3 obtida quando se reagem totalmente 3g de H2?
Resolução:
a. Proporção de quantidade de matérias
3 mol de H2 –––––––– 2 mol de NH3
b. Regra de três
3. 2g de H2 –––––––– 2 . 17g de NH3
3g de H2 –––––––– x
x = 102/6 = 17g de NH3
RELAÇÃO MASSA VOLUME
Basta lembrar que 1 mol de qualquer gás, a 0ºC e 1 atm, ocupa o volume de 22,4 litros.
Exemplo:
Na reação N2(g) + 3H2(g) → 2NH3(g) qual o volume de N2, a 0ºC e 1 atm, obtido quando se reagem totalmente 3g de H2?
Resolução:
- Proporção em mol
1 mol de N2 –––––––– 3 mol de H2
- Regra de três
22,4L de N2 –––––––– 3 . 2g de H2
x –––––––– 3 de H2
x = 22,4/2 = 11,2L
RELAÇÃO MASSA – Nº MOLÉCULAS
Fonte: slideplayer.com
Na reação gasosa N2 + H2 ——— NH3, qual o número de moléculas de NH3 obtido, quando se reagem totalmente 18g de H2?
Acerte os coeficientes da equação: 1N2 +3H2 ——–2NH3.
Veja os dados informados (18g de H2) e o que está sendo solicitado (número de moléculas de NH3) e estabeleça uma regra de três.
3H2 ————– 2NH3
3x2g ————–2x6,02×1023
18g ————– x
x= 18,06×1023 ou x= 1,806×1024 moléculas
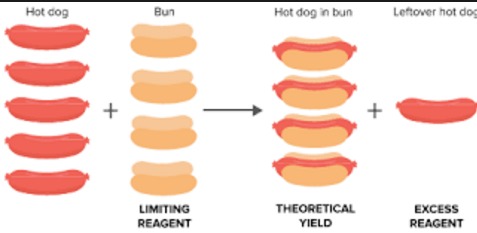
CÁLCULOS ENVOLVENDO EXCESSO DE REAGENTE
Fonte: didatticadigitale.com
Quando o enunciado do exercício fornecer quantidades de 2 reagente, precisamos verificar qual deles estará em excesso, após terminada a reação. As quantidades de substâncias que participam da reação química são sempre proporcionais aos coeficientes da equação. Se a quantidade de reagente estiver fora da proporção indicada pelos coeficientes da equação, reagirá somente a parte que se encontra de acordo com a proporção; a parte que estiver a mais não reage e é considerada excesso.
Por outro lado, o reagente que for totalmente consumido (o que não estiver em excesso) pode ser denominado de reagente limitante porque ele determina o final da reação química no momento em que for totalmente consumido.
Exemplo: Consideremos o caso da combustão do álcool:
Uma massa de 138 g álcool etílico (C2H6O) foi posta para queimar com 320g de oxigênio (O2), em condições normais de temperatura e pressão. Qual é a massa de gás carbônico liberado e o excesso de reagente, se houver?
Resolução:
A reação balanceada é dada por:
1 C2H6O(V) + 3 O2(g) → 2CO2(g) + 3H2O(v)
1 mol 3 mol 2 mol
46 g 96g 88g
138g 320g
Só de analisarmos os dados, vemos que a massa de oxigênio é proporcionalmente maior que a do álcool, assim o oxigênio é o reagente em excesso e o álcool etílico é o reagente limitante.
Calculando a massa de gás carbônico formado a partir da quantidade do reagente limitante:
46g de C2H6O ————88g de CO2
138g de C2H6O ————x
x = 264 g de CO2
Obs: A massa de oxigênio em excesso é determinada de forma análoga:
46g de C2H6O ———— 96 O2
138g de C2H6O ————x
x = 288 g de O2
A massa em excesso é a diferença da massa que foi colocada para reagir e a que efetivamente reagiu:
320g – 288g= 32 g
CÁLCULOS ENVOLVENDO REAGENTE LIMITANTE
O reagente que é totalmente consumido é chamado reagente limitante. Assim que ele é consumido, não se forma mais produto, ou seja, a reação termina. Os demais reagentes são chamados reagentes em excesso. Após o término da reação, sobra uma certa quantidade dos reagentes em excesso: é a quantidade inicial menos a quantidade que reagiu.
Para descobrir qual é o reagente limitante: imagine a reação hipotética a seguir: A + B → produtos, onde A e B são os reagentes.
Se a questão fornece quantidades de A e B usadas na reação, como descobrir qual deles é totalmente consumido?
– escolher um dos reagentes (A, por exemplo) e supor que ele é o limitante;
– calcular, usando regra de três, a quantidade de B necessária para consumir completamente o reagente A;
– se essa quantidade encontrada de B for suficiente (menor do que a quantidade de B dada no enunciado), então o reagente A é o limitante. Caso contrário, a suposição inicial estava errada e o outro reagente (B) é o limitante.
Veja a resolução do exercício de revisão para ficar mais claro. Assim que for encontrado qual é o reagente limitante, os cálculos estequiométricos devem ser feitos usando apenas a quantidade do limitante, pois é ele que é totalmente consumido.
Além disso, problemas de reagente limitante são mais fáceis de se resolver com as quantidades em mol, em vez de massa ou volume gasoso. Na dúvida, passe as quantidades para mol e trabalhe com elas.
Exemplos:
1. Zinco e enxofre reagem para formar sulfeto de zinco de acordo com a seguinte reação:
Reagiu 30g de zinco e 36g de enxofre. Qual é o regente em excesso?
Balancear a reação química:
Dados:
Zn = 30gS = 36g
Transformar a massa em gramas para mol:
Pela proporção da reação 1mol de Zn reage com 1mol de S.
Então 0,46mol de Zn reage com quantos mols de S?
Pode ser feita uma regra de três para verificar qual regente está em excesso:
Então 1mol de Zn precisa de 1mol de S para reagir. Se temos 0,46mol de Zn, precisamos de 0,46mol de S, mas temos 1,12mol de S. Concluímos que o S está em excesso e, portanto o Zn é o regente limitante.
2) Quantos gramas de ZnS será formado a partir dos dados da equação acima?
Para resolver esta pergunta, utiliza-se somente o valor do reagente limitante.
CÁLCULO DE RENDIMENTO
É comum, nas reações químicas, a quantidade de produto ser inferior ao valor esperado. Neste caso, o rendimento não foi total. Isto pode acontecer por várias razões, como por exemplo, má qualidade dos aparelhos ou dos reagentes, falta de preparo do operador, etc.
O cálculo de rendimento de uma reação química é feito a partir da quantidade obtida de produto e a quantidade teórica (que deveria ser obtida).
Quando não houver referência ao rendimento de reação envolvida, supõe-se que ele tenha sido de 100%.
Exemplo:
Num processo de obtenção de ferro a partir do minério hematita (Fe2O3), considere a equação química não-balanceada:
Utilizando–se 480g do minério e admitindo-se um rendimento de 80% na reação, a quantidade de ferro produzida será de:
Equação Balanceada:
Dados: 1Fe2O3 = 480g
2Fe = x (m) com 80% de rendimento
MM Fe2O3 = 160g/mol
MM Fe = 56g/mol
Cálculo de Rendimento:
CÁLCULOS ENVOLVENDO PUREZA
Com frequência as substâncias envolvidas no processo químico não são puras. Assim, podemos esquematicamente dividir uma amostra em duas partes: a parte útil e as impurezas.
– Parte útil ou parte pura: reage no problema à p%
– Impurezas: não reagem no processo do problema à i%
Diante disso, é importante calcularmos a massa referente à parte pura, supondo que as impurezas não participam da reação. Grau de pureza (p) é o quociente entre a massa da substância pura e a massa total da amostra (substância impura).
Exemplo:
Considerando a reação balanceada:
Qual a massa de cloreto ferroso obtida quando 1100g de sulfeto ferroso, com 80% de pureza, reagem com excesso de ácido clorídrico? (Fe = 56u; S = 32u; H = 1u; Cl = 35,5u).
A informação sobre o ácido clorídrico é desnecessária, pois não vamos utilizá-lo em nossos cálculos, já que temos apenas a massa de sulfeto ferroso posta para reagir. Por outro lado, sabemos que o sulfeto ferroso está com impurezas. Vamos então calcular qual a massa deste reagente puro.
1100g de FeS ________ 100%
x _____________ 80%
x = 880g de FeS puro.
Agora sim podemos utilizar as proporções molares para encontrar a massa de cloreto ferroso formada na reação.
1 mol de FeS _______ 1 mol de FeCl2
88g de FeS ____________ 127g de FeCl2
880g de FeS _______________ y
y = 111760/88
y = 1270g de FeCl2
Sistema em que o rendimento não é total
Quando uma reação química não produz as quantidades de produto esperadas, de acordo com a proporção da reação química, dizemos que o rendimento não foi total. Rendimento de uma reação é o quociente entre a quantidade de produto realmente obtida e a quantidade esperada, de acordo com a proporção da equação química.
Mediante aos exemplos acima, foi possível observar que os procedimentos para resolver exercícios de Cálculo da Estequiometria, chamados de estequiométricos, devem seguir os seguintes passos:
A) Escrever a equação da reação química;
B) Acertar os coeficientes (fazer o balanceamento = igualar o número de átomos);
C) Obter a PROPORÇÃO EM MOLS através dos coeficientes estequiométricos.
Lembre-se que o Cálculo estequiométrico é uma questão de treino, basta você ter uma boa interpretação para se sair bem nas questões”
E ai gostou? Ou melhor, compreendeu um pouco sobre a estequiometria?
Vale lembrar que para se dar bem nas questões, você deverá ler, analisar cada caso individualmente. Preciso muito da sua opinião para aperfeiçoar minhas publicações aqui no blog.
Usamos este post para auxiliar e colaborar com a sua compreensão, a fim de que você consiga obter sucesso e a aprovação garantida!!
Deixe seu comentário demonstrando sua opinião, dica ou sugestão sobre esse assunto da estequiometria são muito importantes
Tutora: Janaina Lopes de Oliveira

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.