Desvende os mitos sobre propriedades coligativas e os fatores que nela interferem

Prepare-se para gabaritar a prova, aproveite e verifique o que acontece com essas propriedades quando são adicionados solutos a elas.
Propriedades coligativas das soluções são propriedades que dependem apenas do número de partículas dispersas na solução, independentemente da natureza dessas partículas, podendo ser moléculas ou íons. As propriedades coligativas incluem pressão máxima de vapor, ebulição, ponto de fusão e pressão osmótica.
Efeitos coligativos
A água em seu estado puro à pressão de 1 atm possui ponto de fusão de 0oC e ponto de ebulição de 100oC. Porém, quando adicionamos um soluto à água, o soluto modifica as propriedades físicas da água. Agora a água congela abaixo de 0oC e ferve acima de 100oC. Estas alterações das propriedades físicas da água devido à adição do soluto são denominadas de efeitos coligativos. Para cada propriedade física que modifica temos uma propriedade coligativa que estuda este efeito:
Pressão Máxima de Vapor (PMV)
A pressão máxima de vapor é pressão exercida pelo vapor quando está em equilíbrio dinâmico com o liquido correspondente.
A PMV depende da temperatura e da natureza do líquido. Observa-se experimentalmente que, numa mesma temperatura, cada líquido apresenta sua pressão de vapor, pois esta está relacionada com a volatilidade do líquido.
Fatores que Influenciam
A pressão máxima de vapor depende de alguns fatores:
– Natureza do Líquido – Líquidos mais voláteis como éter, acetona etc. evaporam-se mais intensamente, o que acarreta uma pressão de vapor maior. Quanto maior a pressão de vapor de um líquido, ou melhor, quanto mais volátil ele for, mais rapidamente entrará em ebulição.
– Temperatura – Aumentando a temperatura, qualquer líquido irá evaporar mais intensamente, acarretando maior pressão de vapor.
Tonoscopia (ou Tonometria)
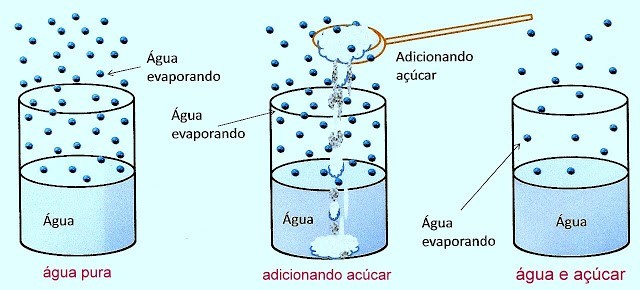
A tonoscopia estuda os efeitos do abaixamento da pressão de vapor máxima de certo líquido, cujo responsável é uma solução não-volátil adicionada à solução.
Em uma solução, quanto maior for o número de mols do soluto, menor será a pressão máxima de vapor dessa solução.
Ebulioscopia
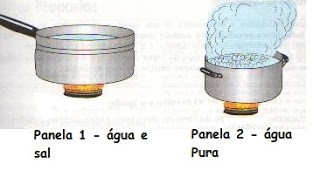
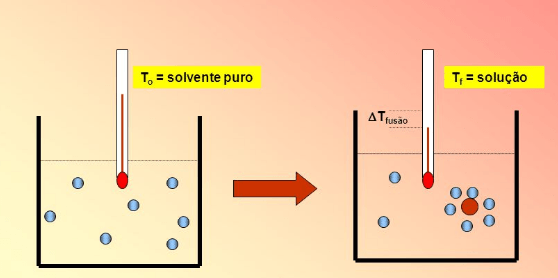
A ebulioscopia é uma propriedade coligativa que ocasiona a elevação da temperatura de um líquido quando a ele se adiciona um soluto não-volátil e não-iônico.
A temperatura em que se inicia a ebulição do solvente em uma solução de soluto não-volátil é sempre maior que o ponto de ebulição do solvente puro (sob mesma pressão).
Isso acontece porque a água, por exemplo, só entrará em ebulição novamente se receber energia suficiente para que sua pressão de vapor volte a se igualar à pressão externa (atmosférica), o que irá acontecer numa temperatura superior a 100°C.
Exemplo:
Água pura: P.E. = 100°C
Água com açúcar: P.E. maior que 100°C
Quanto maior a quantidade de partículas em uma solução, maior será o seu P.E.
Diagrama de Fases e o Ponto Triplo
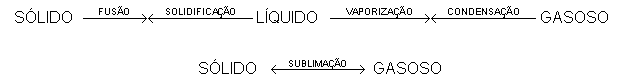
A transformação de cada estado físico possui um nome. Observe:
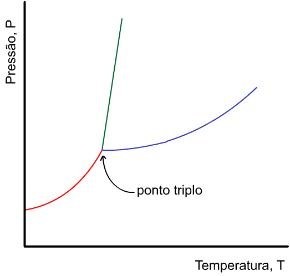
Existe um gráfico que representa as curvas de variação da temperatura de ebulição e da variação da temperatura de solidificação de uma substância qualquer em função da pressão de vapor. Essas curvas coincidem num ponto específico de cada substância.
As curvas de variação das temperaturas de ebulição e de solidificação da água em função da pressão de vapor coincidem no ponto em que a pressão é igual a 4,579mmHg e a temperatura é 0,0098°C.
Esta coordenada representa o Ponto Triplo da água e o equilíbrio das fases. Isto quer dizer que a substância pode ser encontrada, neste ponto exato da curva, nos três estados físicos ao mesmo tempo: sólido, líquido e gasoso.
Equilíbrio das fases:
Crioscopia
É uma propriedade coligativa que ocasiona a diminuição na temperatura de congelamento do solvente. É provocado pela adição de um soluto não-volátil em um solvente. Está relacionado com o ponto de solidificação (PS) das substâncias.
Esta propriedade pode ser chamada também de criometria.
Quando se compara um solvente puro e uma solução de soluto não-volátil, é possível afirmar que o ponto de congelamento da solução sempre será menor que o ponto de congelamento do solvente puro.
Quanto maior o número de partículas dissolvidas em uma solução, menor será o seu ponto de congelamento.
Em países onde o inverno é muito rigoroso, adiciona-se sal nas estradas para provocar a diminuição da temperatura de congelamento da água, evitando que se forme gelo.
Esta propriedade também explica porque grande parte da água do mar não congela a 0°C. A imensa quantidade de sal dissolvida nos mares e oceanos faz com que o seu ponto de congelamento diminua.
Exemplo: a água poluída possui ponto de solidificação menor que o da água limpa. Isso acontece pelo fato de a primeira opção possuir partículas não-voláteis que a segunda não possui. Isso dificulta ainda mais o seu congelamento.
Nos carros, é comum adicionar um anticongelante nos radiadores, o etilenoglicol. Esta substância em solução com a água diminui a temperatura de congelamento para -37°C.
Osmometria
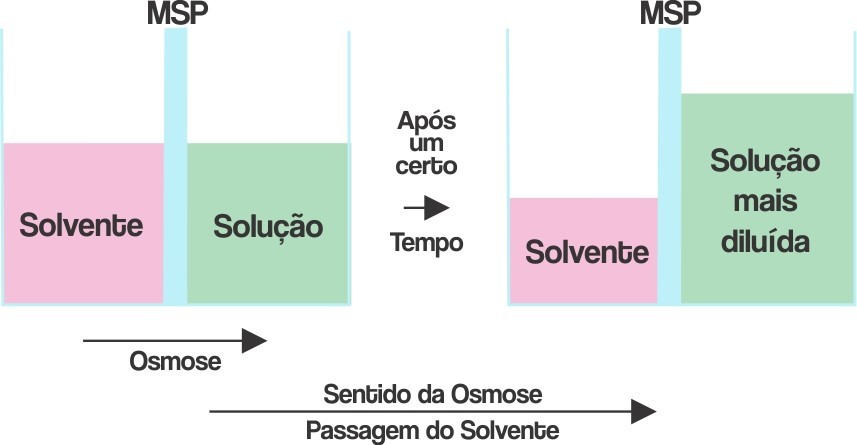
A osmose está relacionada à passagem espontânea de um solvente por uma membrana semipermeável, por causa da diferença de concentração entre dois meios.
Um exemplo comum é evidenciado ao se temperar verduras com sal de cozinha. Nota-se que as verduras murcham após certo tempo de exposição ao tempero. Isso ocorre em função da saída do líquido (solvente) do vegetal, que é um meio menos concentrado em relação ao sal.
A osmometria mede a pressão máxima de vapor: o líquido com maior pressão máxima de vapor tende a atravessar uma membrana semipermeável com maior facilidade e intensidade que aquele que possui baixa pressão máxima de vapor.
A pressão osmótica equivale à pressão que deve ser aplicada sobre a solução mais concentrada do sistema para bloquear a entrada de água nela (osmose), por meio de uma membrana semipermeável. O sistema a seguir mostra a pressão aplicada n sobre a solução, para bloquear o fluxo osmótico.
Para o cálculo da pressão osmótica, usa-se a seguinte expressão:
Para as soluções iônicas:
Onde:
V= volume (L)
n= número de mol (n)
T= temperatura (K)
M= molaridade (mol/L)
R= Constante de Clapeyron=0,082 atm.L/mol.K
I= fator de correção Van´t Hoff
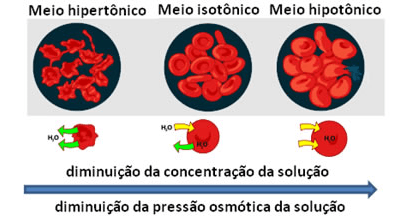
As soluções podem ser classificadas quanto às suas pressões osmóticas.
Sendo duas soluções A e B com mesma temperatura:
Hipertônica, isotônica e hipotônica refere-se à solução A em relação à solução B. Verifique a figura abaixo:
Resumo das Propriedades Coligativas
E então, o que achou deste post sobre propriedades coligativas?
Deixe um comentário dizendo o que achou, e ajude a manter esse trabalho vivo. É sua manifestação que me empolga a manter o conteúdo aqui. Até a próxima!

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.