Resumindo as Ligações Químicas Interatômicas Para Estudar Sem Perder a Cabeça
Olá mais uma vez senhoras e senhores, no post do hoje vamos lembrar os tipos ligações químicas Interatômicas que os átomos fazem entre si.
Se os átomos dos diferentes tipos de elementos não tivessem a capacidade de se combinar, com toda a certeza não seria encontrado na natureza essa grande variedade de substâncias que nosso planeta possui. Para essas “combinações” damos o nome de Ligações, e elas tem uma variação dependendo da estrutura do átomo.
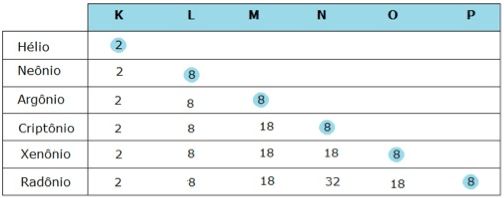
Alguns poucos elementos, como os da família dos gases nobres (família VIIIA), aparecem na forma de átomos isolados. Esses elementos apresentam oito elétrons na camada de valência. O hélio (He) é a única exceção: ele apresenta apenas uma camada com dois elétrons.
Em 1916, os cientistas Lewis e Kossel associaram esses dois fatos, ou seja, a tendência de elementos com oito elétrons na camada de valência aparecerem isoladamente, com a tendência que os elementos manifestam de perder, ganhar ou compartilhar elétrons. A partir dessa associação, propuseram uma teoria para explicar as ligações químicas entre os elementos:
Essa teoria é aplicada principalmente para os elementos representativos (família A), sendo que os elementos de transição (família B) não seguem obrigatoriamente esse modelo. Embora existam muitas exceções a essa regra, ela continua sendo utilizada por se prestar muito bem como introdução ao conceito de ligação química e por explicar a formação da maioria das substâncias encontradas na natureza.
Estabilidade dos Gases Nobres
Regra do Octeto – Os elementos químicos devem sempre conter 8 elétrons na última camada eletrônica ou camada de valência. Na camada K pode haver no máximo 2 elétrons. Desta forma os átomos ficam estáveis, com a configuração idêntica à dos gases nobres.
Essa estabilidade deve-se ao fato de que possuem a última camada completa, ou seja, com o número máximo de elétrons que essa camada pode conter, enquanto última. Os átomos dos demais elementos químicos, para ficarem estáveis, devem adquirir, através das ligações químicas, eletrosferas iguais às dos gases nobres.
Ligações Interatômicas
As ligações interatômicas, ou entre átomos, são feitas de várias formas, mais sempre envolvendo a camada mais externa (camada de valência). Isso indica que são os elétrons do último nível que participam das ligações.
Vamos relembrar os seguintes tipos:
-Ligações iônicas;
-Ligações covalente;
-Ligação coordenada (também conhecida por ligação covalente dativa);
-Ligação metálica.
Ligação iônica
Nas ligações interatômicas iônicas (ou também conhecidas como ligações eletrovalentes) ocorre transferência definitiva de elétrons, o que acarreta a formação de íons positivos (cátions) ou negativos (ânions), os quais originam compostos iônicos. Como todos os íons apresentam excesso de cargas elétricas positivas ou negativas, eles sempre terão polos.
Podemos visualizar a formação de uma ligação iônica típica entre dois átomos hipotéticos, M (um metal) e X (um não-metal), da seguinte maneira: como M é um metal, sua energia de ionização é baixa, isto é, é necessária pouca energia para remover um elétron do átomo. A perda de um elétron por um átomo isolado (gasoso) M leva à formação de um íon positivo ou cátion.
Iônica 1
Por outro lado, como X é um átomo de um não-metal, o valor de sua afinidade eletrônica é negativo, portanto, possui uma grande tendência em ganhar elétrons e formar um ânion.
Iônica 2
Características e Propriedades dos Compostos Iônicos:
-Rígidos;
-Duros e quebradiços
-Solúveis em solventes polares;
-Maus condutores de eletricidade no estado sólido;
-Elevadas temperaturas de fusão e ebulição.
Ligação Covalente
Diferente da ligação iônica, a ligação covalente é estabelecida pela capacidade dos átomos de compartilhar elétrons e não uma transferência definitiva de deles. Ao observar a configuração eletrônica do átomo de cloro por exemplo, ele possui número atômico igual a 17 e sua distribuição eletrônica por camadas é K=2, L=8, M=7. Como sabemos ele precisa de mais um elétron para se tornar estável, entretanto existe um composto formado por dois átomos de Cloro, o Cl2, como é possível que este composto seja estável se os dois átomos de cloro “querem” receber elétrons? Nesse caso a estabilidade dessa molécula não é atingida pela transferência de elétrons, mas sim pelo compartilhamento como já foi citado.
Covalente 1
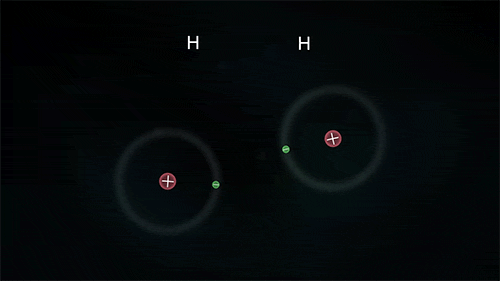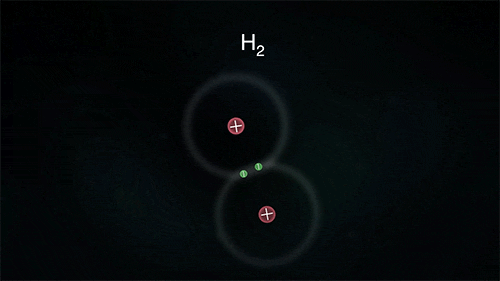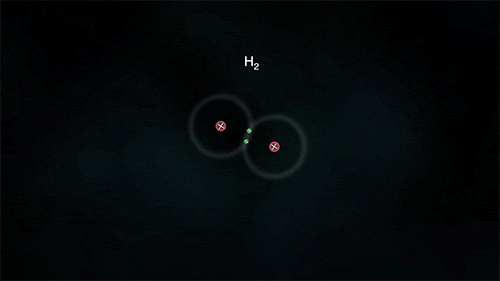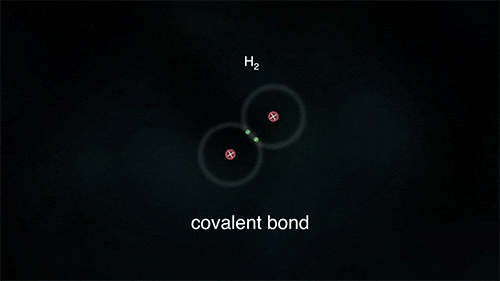
Outro exemplo é a ligação entre átomos do hidrogênio para formar o gás hidrogênio H2, porém para ele se estabilizar necessita de apenas 2 elétrons na última camada.
As substâncias formadas através das ligações covalentes apresentam-se como unidades de grandeza limitada, denominadas moléculas; por isso a ligação covalente é também denominada de ligação molecular.
A ligação covalente pode ocorrer através de um ou mais pares de elétrons. Cada par eletrônico compartilhado entre dois átomos pode ser representado, nas fórmulas estruturais, por um traço (-). Assim, podemos ter:
Covalente 2
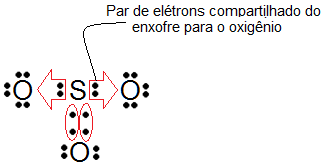
Ligação Covalente Dativa
A ligação covalente dativa, também chamada de coordenada, ocorre quando um dos átomos envolvidos já atingiu a estabilidade e um outro átomo ainda precisa de dois elétrons para completar sua camada de valência. Essa ligação é semelhante à covalente comum, na medida em que existe um compartilhamento de um par eletrônico.
(Ligação covalente dativa)
Dativa
Resumindo:
A ligação covalente ocorre entre:
Hidrogênio – Hidrogênio
Hidrogênio – Não-metal
Não-metal – Não-metal
Obs.: Os semimetais também podem ser incluídos.
Ligação Metálica
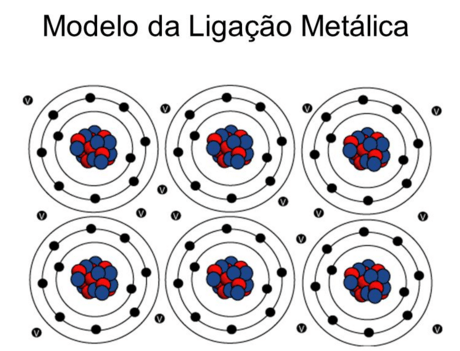
É o tipo de Ligação Interatômicas que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada. Forma-se, então, uma rede ordenada de íons positivos mergulhada num mar de elétrons em movimento aleatório. Se aplicarmos um campo elétrico a um metal, orientamos o movimento dos elétrons numa direção preferencial, ou seja, geramos uma corrente elétrica.
Teoria do “Mar de Elétrons” ou Teoria da “Nuvem Eletrônica”
A principal característica dos metais é a eletropositividade (tendência de doar elétrons), assim os elétrons da camada de valência saem facilmente do átomo e ficam “passeando” pelo metal, o átomo que perde elétrons se transforma num cátion, que, em seguida, pode recapturar esses elétrons, voltando a ser átomo neutro. O metal seria um aglomerado de átomos neutros e cátions, imersos num “mar de elétrons livres” que estaria funcionando como ligação metálica, mantendo unidos os átomos e cátions de metais.
Característica e Propriedades dos Metais:
-Brilho metálico: o brilho será tanto mais intenso quanto mais polida for a superfície metálica, assim os metais refletem muito bem a luz.
-Condutividades térmica e elétrica elevadas: os metais são bons condutores de calor e eletricidade pelo fato de possuírem elétrons livres.
-Densidade elevada: os metais são geralmente muito densos, isto resulta das estruturas compactas devido à grande intensidade da força de união entre átomos e cátions (ligação metálica), o que faz com que, em igualdade de massa com qualquer outro material, os metais ocupem menor volume.
-Resistência à tração: os metais resistem às forças de alongamentos de suas superfícies, o que ocorre também como consequência da “força” da ligação metálica.
-Pontos de fusão e ebulição elevados: os metais apresentam elevadas temperaturas de fusão e ebulição, isto acontece porque a ligação metálica é muito forte.
-Maleabilidade: a propriedade que permite a obtenção de lâminas de metais.
-Ductilidade: a propriedade que permite a obtenção de fios de metal.
Alguma dúvida meus caros amigos?
Essa matéria de Ligações Interatômicas é tranquila, certo? Agora pratiquem pra garantir a fixação e não errar na hora da prova.
Não esqueçam de curtir e compartilhar e Bons Estudos!
Referências:
Sardella, A.; Química – São Paulo, 2003. Editora Ática
https://www.docsity.com/en/news/education-2/types-chemical-bonding-presented-gifs/

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.






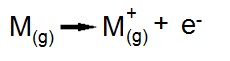
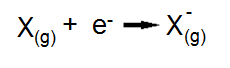
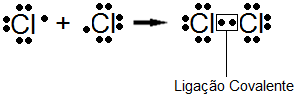


Muito obrigado, gostei muito do formato, trazendo textos e imagens para melhor compreensão, show de bola !! Vai me ajudar bastante na Olimpíadas Baianas de Química.
Bom dia Ítalo. Obrigada por deixar aqui o seu comentário no post. Parabéns desde já pelo empenho em prestar a Olimpíadas de Química, essa determinação é fundamental para o seu futuro. Temos mais posts sobre Química em nosso post, acesse: http://blog.maxieduca.com.br/quimica/ E mais uma vez obrigada por estudar através de nosso blog. Acompanhe-nos nas redes sociais. Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
olá. Adorei o site! Vocês me ajudam muito a estudar! obrigada.
Olá Camila, tudo bem? Que bom que gostou do nosso blog! Aproveite e navegue por nosso site (www.maxieduca.com.br), garanto que você também vai gostar. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
Parabéns pelo trabalho, me deu uma ótima compreensão, muito bom!
Olá Werlys, tudo bem? Que bom que gostou do nosso blog! Aproveite e navegue por nosso site (www.maxieduca.com.br), garanto que você também vai gostar. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
O conteúdo é muito bom?????. Parabéns!
Olá Amanda, tudo bem? Que bom que gostou do nosso blog! Aproveite e navegue por nosso site (www.maxieduca.com.br), garanto que você também vai gostar. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW