Descomplique os conceitos de matéria e suas propriedades gerais e específicas.

Você lembra de como a matéria é classificada?
E além disso, você tem ideia do que costuma ser cobrado nos concursos públicos sobre este assunto? Que tal relembrar e mandar ver na prova?
Para maiores esclarecimentos do conteúdo, veja a seguir o que você precisa ficar atento para sair bem nas questões.
Denomina-se matéria tudo aquilo que tem massa e ocupa lugar no espaço e, desse modo, possui volume. Podemos citar como exemplos de matéria a madeira, o ferro, a água, o ar e tudo o mais que imaginemos dentro da definição acima. A ausência total de matéria é o vácuo.
Substância é uma composição de apenas um tipo de moléculas ou átomos. A substância pode ser simples ou composta.
Substância simples é aquela constituído por um único tipo de constituinte. Ex: o ferro, contendo somente átomo de ferro; o oxigênio, contendo só O2.
Substância composta é aquela constituída por mais de um tipo de constituinte. Ex: a água pura contendo somente H2O; o sal, contendo somente NaCl;
Mistura consiste em duas ou mais substâncias misturadas. Ela pode ser identificada visualmente, como por exemplo o granito onde se observa grãos de quartzo branco, mica preta e feldspato rosa e outros minérios. Outras misturas como a água salgada, requer outros métodos de verificação para sabermos se são substâncias ou misturas.
Corpo: É uma porção limitada da matéria. Por exemplo, conforme dito, uma árvore é uma matéria; assim, quando cortamos toras de madeira, temos que essas toras podem ser designadas como corpos ou como matéria também.
Objeto: É um corpo produzido para utilização do homem. Se as toras de madeira mencionadas no item anterior forem transformadas em algum móvel, como uma mesa, teremos um objeto.
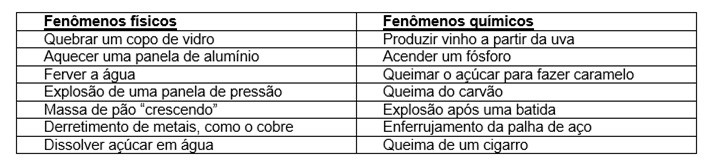
Fenômeno físico: é toda alteração na estrutura física da matéria, tais como forma, tamanho, aparência e estado físico, mas que não gere alteração em sua natureza, isto é, na sua composição.
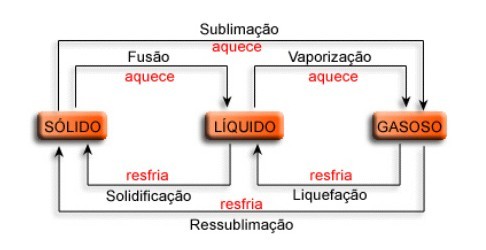
Mudanças de Estados Físicos da Água
As Mudanças de Estados Físicos da Água são divididas em 5 processos, a saber.
-Fusão: Mudança do estado sólido para o estado líquido da água, provocada por aquecimento, por exemplo, um gelo que derrete num dia de calor. Além disso, o denominado “Ponto de Fusão” (PF) é a temperatura que a água passa do estado sólido para o líquido. No caso da água, o ponto de fusão é de 0ºC.
-Vaporização: Mudança do estado líquido para o estado gasoso por meio do aquecimento da água. Assim, o “Ponto de Ebulição” (PE) de uma substância é a temperatura a que essa substância passa do estado líquido para o estado gasoso e, no caso da água, o é de 100ºC. Vale lembrar que a Ebulição e a Evaporação são, na realidade, tipos de vaporização. A diferença de ambas reside na velocidade do aquecimento, ou seja, se for realizado lentamente chama-se evaporação; entretanto, se for realizado com aquecimento rápido chama-se ebulição.
-Solidificação: Mudança de estado líquido para o estado sólido provocado pelo arrefecimento ou resfriamento. Além disso, o “Ponto de Solidificação” da água é de 0ºC. O exemplo mais visível são os cubos de água que colocamos no refrigerador para fazer os cubos de gelo.
-Liquefação: Chamada também de Condensação, esse processo identifica a mudança do estado gasoso para o estado líquido decorrente do resfriamento (arrefecimento). Como exemplo podemos citar: a geada e o orvalho das plantas.
-Sublimação: Mudança do estado sólido para o estado gasoso, por meio do aquecimento. Também denomina a mudança do estado gasoso para o estado sólido (ressublimação), por arrefecimento, por exemplo: gelo seco e naftalina.
Fenômeno químico: ocorre quando há alteração da natureza da matéria, isto é, da sua composição.
Dizemos que ocorreu uma reação química, pois novas substâncias foram originadas.
Propriedades da matéria
Propriedades são uma série de características que, em conjunto, definem a espécie de matéria. Podemos dividi-las em 3 grupos: gerais, funcionais e específicas.
1. Propriedades gerais
São as propriedades inerentes a toda espécie de matéria.
Massa: é a grandeza que usamos como medida da quantidade de matéria de um corpo ou objeto.
Extensão: espaço que a matéria ocupa, seu volume.
Impenetrabilidade: é o fato de que duas porções de matéria não podem ocupar o mesmo espaço ao mesmo tempo.
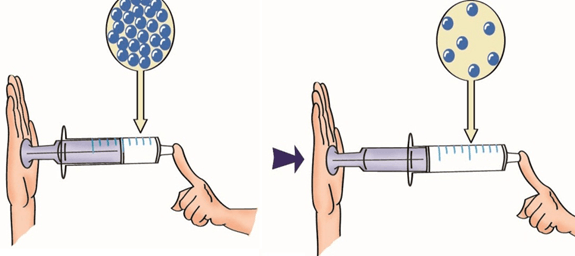
Divisibilidade: toda matéria pode ser dividida sem alterar a sua constituição (até um certo limite).
Compressibilidade: o volume ocupado por uma porção de matéria pode diminuir sob a ação de forças externas.
Elasticidade: se a ação de uma força causar deformação na matéria, dentro de um certo limite, ela poderá retornar à forma original.
2. Propriedades funcionais
São propriedades comuns a determinados grupos de matéria, identificadas pela função que desempenham. A Química se preocupa particularmente com estas propriedades. Podemos citar como exemplo de propriedades funcionais a acidez, a basicidade, a salinidade de algumas espécies de matéria.
3.Propriedades específicas
São propriedades individuais de cada tipo particular de matéria.
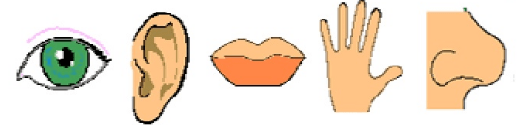
Organolépticas: são aquelas capazes de impressionar os nossos sentidos, como a cor, que impressiona a visão, o sabor e o odor, que impressionam o paladar e o olfato respectivamente, e a fase de agregação da matéria, que pode ser sólida (pó, pasta), líquida ou gasosa e que impressiona o tato.
Químicas: são propriedades responsáveis pelos tipos de transformação que cada matéria é capaz de sofrer. Por exemplo, o vinho pode se transformar em vinagre; o ferro pode se transformar em aço, mas o vinho não pode se transformar em aço nem o ferro em vinagre.
Físicas: são certos valores constantes, encontrados experimentalmente, para o comportamento de cada tipo de matéria, quando submetida a determinadas condições. Essas condições não alteram a constituição da matéria, por mais adversas que sejam. Por exemplo: sob uma pressão de 1 atmosfera, a água passa de líquida para gasosa à temperatura de 100°C, sempre.
Propriedades extensivas e intensivas da matéria
As propriedades físicas também podem ser classificadas, de acordo com a quantidade da amostra, em extensivas e intensivas.
As propriedades extensivas variam conforme a quantidade de material contido na amostra. É o caso da energia liberada em uma combustão: duplicando, por exemplo, a quantidade de combustível, duplica-se a quantidade de energia liberada.
As propriedades intensivas são as que não dependem da quantidade de material contido na amostra. É o caso da temperatura e da densidade, que não se alteram quando a quantidade de material é modificada.
Energia e as propriedades químicas dos materiais
Referem-se àquelas que, quando são coletadas e analisadas, alteram a composição química da matéria, ou seja, referem-se a uma capacidade que uma substância tem de transformar-se em outra por meio de reações químicas.
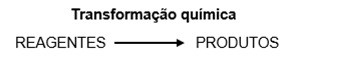
Essas transformações resultam na produção permanente e irreversível de um novo material (produto), com características distintas do inicial (reagente), sendo desse modo classificadas como transformações químicas ou reações químicas.
Uma maneira de comprovar a existência de uma transformação química é através da comparação do estado inicial e final do sistema. Algumas evidências podem ser observadas, permitindo verificar a ocorrência dessas transformações, como: desprendimento de gás e luz, mudança de coloração e cheiro, formação de precipitados entre outras
As transformações químicas podem ocorrer de distintas maneiras, sendo estas:
-Por ação do calor
Muitas substâncias são transformadas quando submetidas a uma fonte de calor. O cozimento de alimentos é um exemplo.
Quando há decomposição de um material devido ao calor, chamamos o processo de termólise Ex: Termólise do magnésio.
Magnésio + oxigênio → óxido de magnésio
-Por ação de uma corrente elétrica
Algumas substâncias necessitam de energia elétrica para que possam se transformar. A esse processo damos o nome de eletrólise.
Para a decomposição da água, em hidrogênio e oxigênio, por exemplo, utilizamos uma corrente elétrica para esta transformação.
-Por ação da luz
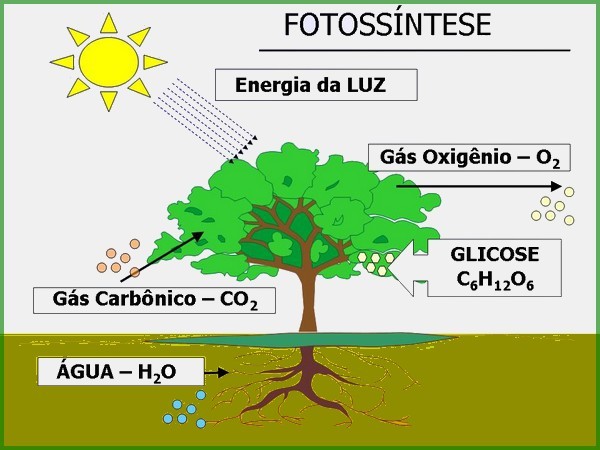
A fotossíntese é um exemplo de reação química que ocorre na presença da luz, onde a água e o dióxido de carbono do ar são transformados em oxigênio e glicose.
A transformação do oxigênio em ozônio acontece através da luz ultravioleta. Essa reação por ação da luz também é de extrema importância, pois assim é formada a camada de ozônio que protege a Terra dos raios ultravioletas.
-Por ação mecânica
Uma ação mecânica (atrito ou choque) é capaz de desencadear transformações em certas substâncias. Um exemplo é o palito de fósforo, que quando entra em atrito com a caixinha que o contém, produz uma faísca, que faz as substâncias inflamáveis do palito entrarem em combustão.
-Pela junção de substâncias
Através da junção de duas substâncias podem ocorrer reações químicas. Isso frequentemente ocorre em laboratórios de química. A adição do sódio metálico em água é um exemplo.
Energia: É a medida da capacidade de realizar um trabalho.
Existem vários tipos de energia, dependendo do tipo de trabalho realizado. Por exemplo, a energia que um corpo adquire quando está em movimento é a energia cinética.
A energia que o corpo armazena é a energia potencial.
A energia mecânica é toda forma de energia relacionada com o movimento de corpos ou com a capacidade de colocá-los em movimento ou de deformá-los.
A energia química é baseada na força de atração e repulsão nas ligações químicas, presente na formação da matéria. As trocas de calor são energias térmicas.
A condução de eletricidade é uma energia elétrica, e a energia na forma de luz é a energia luminosa.
E ai gostou? Ou melhor, compreendeu um pouco sobre a classificação de matéria?
Usamos este post para auxiliar e colaborar com a sua compreensão, a fim de que você consiga obter sucesso e a aprovação garantida!!

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.









muito legal esse aplicativo vai me ajudar muito na prova de ciencias
Bom dia Valdirene. Ficamos felizes que tenha gostado do nosso material e principalmente que ele pode contribuir com os seus estudos. Sugerimos que continue acessando outros posts, pois temos muitos assuntos. Agradecemos seu contato. Acompanhe-nos também nas redes sociais. Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
Gostei desse blog. Muito bem explicado.
Olá Gustavo, tudo bem? Que bom que gostou do nosso blog! Aproveite e navegue por nosso site (www.maxieduca.com.br), garanto que você também vai gostar. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW