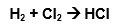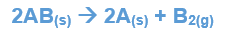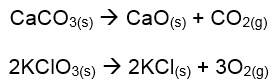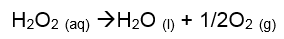Não se esqueça o que são reações químicas e venha relembrar esse assunto

Faaaaalaaaaa Pessoal! O blog de hoje é sobre os tipos de reações químicas. Lembra do que são fenômenos químicos? . Pois é, essas transformações da matéria que fazem os átomos se rearranjarem e se ligarem de formas diferentes são chamadas de reações e elas podem ser classificadas em diferentes tipos. Então aponta o lápis e prepara o caderno de anotações pra não deixar nada passar.
fonte: http://arhe.msk.ru/?p=2595
Bom jovem Padawan, como eu já citei as reações químicas são transformações da matéria que envolvem alterações, de quebra e/ou formação, das ligações entre íons, átomos ou moléculas que irão se rearranjar e formar diferentes substâncias. Para verificar se uma reação aconteceu podemos observar coisas simples como mudança de cor, alteração de temperatura, produção de luz, formação de gases, etc.
As reações acontecem o tempo todo no nosso dia a dia, como quando vamos cozinhar ou até mesmo na digestão dos alimentos, na produção de medicamentos, naquele carro abandonado do outro lado da rua e que está cada dia mais enferrujado. Tudo isso são exemplos de reações químicas e para representa-las usamos equações químicas.
Equações Químicas[1]
A equação química é escrita em duas partes, o lado dos reagentes e o lado dos produtos. Os reagentes são as substâncias iniciais da reação, ou seja, é aquilo que vai se transformar em algo. Consequentemente o os produtos são as novas substâncias formadas.
Nas equações químicas são utilizados símbolos e números para descrever os nomes e as proporções das diferentes substâncias que entram nessas reações. Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito.
Na reação a matéria não e criada e nem destruída, os átomos somente são reorganizados de forma diferente, por isso uma equação química deve ser balanceada, ou seja, o número de átomos da esquerda precisa ser igual o número de átomos da direita. Sendo assim, balancear uma equação é fazer com que ela entre em equilíbrio.
Exemplo de uma Equação Química não equilibrada:
A equação acima está desbalanceada, pois temos nos reagentes (H2 e Cl2) dois átomos de cada elemento, e no produto (HCl) somente uma molécula.
Exemplo de uma Equação Química equilibrada:
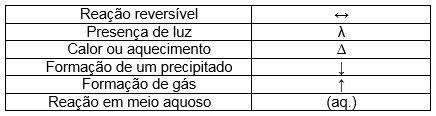
Ainda sobre as equações químicas, é importante ressaltar que ela podem trazer as mais diversas informações, e todas elas podem ser representadas por símbolos, como por exemplo:
Os símbolos para representar os estados físicos dos componentes das reações são os seguintes:
Gás = (g)
Vapor = (v)
Líquido = (l)
Sólido = (s)
Cristal = (c)
Tipos de Reações Químicas
Reação de síntese ou adição
Nesta reação duas ou mais substâncias se juntam para formar uma outra substância, podendo elas serem simples ou compostas.
Um bom exemplo dessa reação se faz presente em flashes fotográficos descartáveis e foguetes sinalizadores.
Ao se queimar uma fita de magnésio, o oxigênio presente no ar reage com o magnésio da fita, originando o óxido de magnésio:
Reação de Análise ou Decomposição
A reação de decomposição ou de análise é um dos tipos de reações químicas na qual determinado composto se decompõe (“separa”), por ação espontânea se instável e não espontânea se estável, ao se desfragmentar quimicamente, dá origem à pelo menos dois produtos diferentes. Como exemplifica a reação a seguir:
Nessa reação, um composto simples AB se decompõe em duas substâncias simples A e B. Os símbolos subscritos (s, g) significam o estado de agregação das matérias envolvidas: sólido e gasoso, respectivamente. Ocorre na decomposição do NaCl em Sódio sólido e Cloro gasoso: como o NaCl é extremamente estável, é necessário algum processo (geralmente eletroquímico) para que os átomos de cada molécula-íon sejam separados.
Vários fatores podem causar a decomposição de um composto, entre eles, vamos destacar três:
Pirólise: Quando algumas substâncias compostas são submetidas ao aquecimento, elas se decompõem. Esse tipo de reação é chamado de pirólise, isto é, quebra de um composto por meio do fogo. Como por exemplo na decomposição do carbonato de cálcio e no clorato de potássio:
Fotólise[2]: Esse tipo de reação quando a luz causa a decomposição dos compostos. A água oxigenada (peróxido de hidrogênio), está sujeita à fotólise, como representado na equação química:
Eletrólise: Nas reações de eletrólise as substâncias se decompõem pela passagem de corrente elétrica
Reação de simples troca ou deslocamento
Esse tipo de reação ocorre quando uma substância simples reage com uma composta originando novas substâncias: uma simples e outra composta.
Uma das mais comuns desse tipo é quando uma lâmina de zinco é introduzida em uma solução aquosa de ácido clorídrico, vai ocorrer a formação de cloreto de zinco e o gás hidrogênio vai ser liberado.
A reação e classificada como de deslocamento uma vez que o zinco “deslocou” o hidrogênio
Reação de substituição ou dupla troca
A reação de dupla troca ocorre quando dois reagentes reagem formando dois produtos, ou seja, se duas substâncias compostas reagirem dando origem a novas substâncias compostas recebem essa denominação.
Importante: Para a ocorrência da reação de dupla troca, pelo menos uma das três condições abaixo deve ocorrer:
-Formar-se pelo menos um produto insolúvel;
-Formar-se pelo menos um produto menos ionizado (mais fraco);
-Formar-se pelo menos um produto menos volátil.
Um exemplo dessa reação entre o ácido sulfúrico com hidróxido de bário produz água e sulfato de bário.
O produto sulfato de bário: BaSO4(s) é um sal branco insolúvel.
É isso ai senhoras e senhores, espero que tenham gostado do blog de hoje. Não se esqueçam de curtir, compartilhar e comentar!
Até a próxima e Toucheee!
[1] Canto, E. L.; Peruzzo, F. M.; Química na abordagem do cotidiano – 4ª Edição, São Paulo. Editora Moderna. 2010.
[2] SOUZA, Líria Alves De. “Tipos de Reações Químicas”; Brasil Escola.

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.